

г. Киев, Михайловская, 21

+38 (066) 221 79 79
+38 (096) 515 79 79
+38 (093) 414 79 79
13 мая. 2020
Все Новости
По данным экспертов ВОЗ, основанным на последних результатах эпидемиологических исследований, интактный пародонт встречался лишь в 2-10 % наблюдений, заболевания пародонта отмечаются у 90-95 % взрослого населения. Увеличение распространенности генерализованных заболеваний тканей пародонта приходится в основном на возраст от 30 до 50 лет, и к 45 годам достигает 96 %. Среди молодежи в возрасте от 16 до 20 лет распространенность заболеваний тканей пародонта резко увеличивается и встречается в 50-85 %.
Повышенная распространенность генерализованных заболеваний тканей пародонта, характеризующихся длительным хроническим течением, со склонностью к периодическому обострению с последующим прогрессированием воспалительно-дистрофического процесса, который приводит к развитию структурных и функциональных нарушений зубочелюстного аппарата, является одной из основных медико-социальных проблем.
В этой связи разработка новых подходов к лечению ГП, направленных на достижение долговременной стабилизации в течении ГП, занимает одно из приоритетных направлений в развитии современной стоматологии
Исследования последних лет позволили существенно углубить представление о механизмах возникновения и прогрессирования хронических дистрофически-воспалительных заболеваний пародонта. Согласно современным представлениям этиологические факторы ГП традиционно подразделяются на местные и системные. К местным относятся факторы, которые действуют непосредственно на ткани пародонта, тогда как системные зависят от общего состояния больного
Среди наиболее значимых этиологических факторов развития ГП исследователи выделяют влияние пародонтопатогенных микроорганизмов и продуктов их жизнедеятельности на ткани пародонта, на состояние полости рта, что способствует образованию зубной бляшки и влияет на пародонтопатогенный потенциал микрофлоры, общие (системные) факторы, обеспечивающие гомеостаз пародонта на фоне имеющейся генетической предрасположенности, изменения реактивности организма. Среди важных факторов риска развития ГП также называют нарушение микроциркуляции и транскапилярного обмена, дисбаланс иммунокомпетентных систем, привлечение аутоиммунитета, недостаточность антиоксидантной защиты.
Согласно “сосудистой теории” патогенеза ГП – микроциркуляторные расстройства появляются уже на ранних стадиях ГП и сопровождают все периоды заболевания. Они характеризуются торможением скорости кровотока, агрегацией и стазом форменных элементов крови, повреждением эндотелиальных клеток, что способствует тромбообразованию.
Высокая распространенность заболеваний, сопровождающихся дисфункцией эндотелия (ЭД), прежде всего атеросклероза, способствует развитию дисбаланса между механизмами антиоксидантной защиты и скоростью СРО. Перекисное окисление фосфолипидов клеточных мембран способствует их деструкции, повреждению клеток пародонта, что в свою очередь снижает устойчивость тканей к повреждающим этиологическим факторам, в т. ч. и микробного воздействия.
Накопление недоокисленных продуктов способствует и изменениям в костной ткани альвеолярного отростка с активацией процессов резорбции кости и деструкции коллагеновых волокон. Активация СРО сопровождается изменением рН клеток эндотелия сосудов, тканей пародонта с развитием метаболического ацидоза и изменений свойств клеточных мембран . Современные представления о роли оксидативного стресса в патогенезе хронического пародонтита позволяют рассматривать содержание переокисленных липидов в слюне и ее антиокислительный потенциал в качестве предикторов эскалации воспалительного поражения пародонта.
Таким образом, возникновению функциональных и морфологических изменений в тканях пародонта способствуют универсальные патогенетические механизмы, формирующиеся при различных заболеваниях органов и систем.
Поэтому при лечении становится актуальной клеточная инженерия, базирующаяся на использовании для активации процессов репаративной регенерации тканевых структур факторов роста, которые продуцируют многие клетки, например, тромбоциты.
Еще в 1990-х гг. было доказано, что в тромбоцитах нашей крови имеются факторы роста – белки, которые стимулируют развитие стволовых клеток и превращение их в клетки той ткани организма, которая повреждена.
Терапевтический эффект тромбоцитарной аутоплазмы (ТАП) объясняется присутствием тромбоцитов и содержащихся в них факторов роста (ФР), но эффект плазмы крови может быть основан и на других качественных составляющих, например микро- и макроэлементах, витаминах, находящихся в наиболее биодоступном для тканей состоянии.
В настоящее время основной целью исследований процессов регенерации является необходимость идентификации ФР, знания механизма их действия и возможностей применения для улучшения регенерации раневой поверхности.
Использование ТАП сегодня представляет одну из немногих возможностей запускать и ускорять естественные механизмы регенерации за счет содержащихся в тромбоцитах ФР. Кроме того, она не токсична и не иммунореактивна. Получение ТАП подразумевает разделение плазмы и тромбоцитов от эритроцитов как по градиенту плотности, так и с использованием специализированных лабораторных фильтров.
ТАП модулирует и регулирует функцию первичных, вторичных и третичных ФР, влияя на все стадии регенерации одновременно. Упомянутое свойство отличает ФР тромбоцитарной аутоплазмы от рекомбинантных ФР, отвечающих за отдельный механизм регенерации.
Тромбоциты в своем составе имеют разнообразные ФР и цитокины, которые способствуют восстановлению поврежденных тканей. В α-гранулах тромбоцитов находятся свыше 30 ФР, которые влияют на процессы регенерации тканей пародонта одновременно. Наибольшее значение имеют: IGF (инсулиноподобный ФР) – способствует дифференцированию стволовых клеток, увеличивает метаболизм костной ткани и продуцирование коллагена. PDGF (тромбоцитарный ФР) – стимулирует пролиферацию и перемещение мезенхимальных (остеогенных) клеток, стимулирует ангиогенез. PDEGF (тромбоцитарный ФР эндотелиальных клеток) – вызывает стимулирующее действие на эндотелиальные клетки и обладает ангиогенным эффектом. VEGF или PDAF (ФР эндотелия сосудов) – имеются 4 вида фактора VEGF-A, -B, -C и -D. Участвуют в ангиогенезе, индуцируют пролиферацию эндотелиальных клеток сосудов. EGF (эпидермальный ФР) – способствует пролиферации фибро- и остеобластов, увеличивает синтез фибронектина. TGF-ß («Семейство» трансформирующего ФР) – многофункциональные факторы, т. к. не только индуцируют дифференцирование мезенхимальных клеток, а также вызывают большое количество клеточных и межклеточных ответов, включая продукцию других ФР. К трансформирующим ФР относятся костные морфогенетические белки, часть которых (КМБ-2, остеогенин или КМБ-3, КМБ-4, -5, -7, -8 и -9) являются выраженными остеоиндукторами, модулируют клеточную пролиферацию и дифференцировку малодифференцированных клеток в остеобласты. PLGF-1/-2 (плацентарные ФР) – потенцируют действие VEGF, повышают проницаемость сосудистой стенки. FGF (фибробластный ФР) – вызывает экспрессию в костной ткани, ангиогенез, оссификацию, индуцирует продукцию TGF в остеобластных клетках. Остеонектин – «культуральный шоковый протеин»: составляет 15 % органического компонента костного матрикса, регулирует пролиферацию и взаимодействие клеток с матриксом. Тромбоспондин – опосредует адгезию костных клеток. ФР доставляются в ткани при инъекционной форме аутоплазмы и концентрируются при помощи введения большего количества аутоплазмы – это повышает активность фибробластов и стимулирует их образование. Фибробласты продуцируют коллагеновые волокна, гиалуроновую кислоту и эластин. Все это приводит к образованию новой соединительной ткани, росту капилляров. ФР также блокируют остеокласты и стимулируют пролиферацию остеобластов, что сдерживает дальнейшую убыль костной ткани и способствует ее регенерации. В итоге восстанавливаются обменные процессы, улучшаются микроциркуляция и метаболизм в клетках тканей, нормализуется тканевое дыхание, активизируется местный иммунитет.
Противопоказаниями к использованию метода являются: злокачественные новообразования; системные заболевания крови, психические заболевания, аллергическая реакция на антикоагулянт (натрий-гепарин) в анамнезе.
Для лечения пациентов используется аутоплазма полученная по следующим методикам.

1) Получение обогащённой тромбоцитами плазмы PRP (Platelets Reach Plasma, Lifting-Plasma), которая в дальнейшем НЕ загустеет. Для использования PRP-плазмы используют антикоагулянт. Её используют для PRP-терапии. Методика получения PRP предполагает, что плазма не свернётся ни до введения в организм пациента, ни после. Механизм действия – всё те же факторы роста.
В пробирках для получения формы PRP – Platelet rich plasma мы используем антикоагулянт ACD – A. Выбор антикоагулянта не случаен. Именно этот антикоагулянт позволяет обеспечить максимальную выживаемость и активность тромбоцитов. В банках крови именно это антикоагулянт используется для хранения тромбоцитарной массы. При однократном центрифугировании в пробирке мы видим разделение на эритроцитарно-лейкоцитарный слой (темный) и плазму. Иногда между ними есть ярко выраженный белесый слой, он называется Buffy Coat – это фракция антикоагулированного образца крови, которая содержит большинство лейкоцитов и тромбоцитов после центрифугирования в градиенте плотности крови.
2) PRF (Platelets Reach Fibrin) – богатый тромбоцитами фибрин, антикоагулянт не используется:
а) A-PRF (advance, то есть «улучшенный», PRF-сгустки) – получение обогащённой тромбоцитами плазмы, которая загустеет до применения (антикоагулянт не используется). Это загустевшая часть плазмы крови, содержащая много факторов роста для остео- и ангиогенеза. Из них можно приготовить мембраны и пробки с помощью специального бокса PRF-BOX. Суть PRF-BOX в отжатии фибрина с целью его освобождения от лишней плазмы. Мембранами укрывают костные материалы, дефекты неба после забора десневых трансплантатов, мембрану Шнайдера при её перфорациях и просто синус-лифтах, используют для хирургии пародонта. Пробки – для заполнения постэкстракционных лунок зубов и пародонтальных дефектов. Так же, сгустки можно нарезать ножницами на мелкие кусочки и смешивать их с костными заменителями.
б) i-PRF (injectable – инъекционный) – получение обогащённой тромбоцитами плазмы, которая загустеет после применения. Такую плазму используют для смешивания с костным заменителем, с целью его стабилизации и придания ему определенной формы. Для инъекций в пародонтальные ткани c целью улучшения их кровоснабжения, изменения биотипа десны. Иногда для склеивания краев слизистой оболочки, например, мембраны Шнайдера.
Для получения PRF необходимое количество крови быстро забирается в пробирки без антикоагулянта и сразу же центрифугируется и после центрифугирования у нас есть 8-12 минут для инъекций, потому что отсутствие антикоагулянта приводит к неминуемому свертыванию полученной плазмы и самое прекрасное, если мы введем плазму в жидком виде, а процесс свертывания завершиться в тканях, формируя естественную матрицу для клеточного восстановления тканей
Активация тромбоцитов в ответ на повреждение тканей происходит во время процесса высвобождения PRF нескольких биологически активных белков, в том числе; альфа-гранулы тромбоцитов, фактор роста, полученный из тромбоцитов (PGDF), трансформирующие факторы роста-β (TGF-β), сосудистый эндотелиальный фактор роста (VEGF) и эпидермальный фактор роста. На самом деле цитокины тромбоцитов и лейкоцитов играют важную роль в ролевой игре этого биоматериала, но поддерживающий их фибриновый матрикс очень полезен для формирования определяющих элементов, отвечающих за реальный терапевтический потенциал PRF. Цитокины немедленно используются и разрушаются в заживающей ране. Гармония между цитокинами и поддерживающей их фибриновой матрицей имеет гораздо более уникальное значение, чем любое другое производное тромбоцитов.
3) PPP – Platelet Poor Plasma – тромбоцитами плазма с концентрацией тромбоцитов “Norma”. В пробирках с зеленым стикером исходно есть разделительный гель. Это удобно, потому что гель после центрифугирования поднимается и плотно фиксирует эритроцитарно-лейкоцитарный сгусток, препятствуя смешиванию с плазмой, НО параметры центрифугирования для пробирок содержащих гель не позволяют применить низкие скорости центрифугирования и в связи с этим конечный продукт, плазма, не может содержать высокие концентрации тромбоцитов, однако содержание белков, аминокислот, минералов и всего остального остается неизменным, что дает нам возможность применять эту форму практически везде, так как она восстанавливает все нарушенные функции тканей.
Сегодня существует широкий арсенал методов и средств, разработанных для комплексного лечения генерализованного пародонтита и хронического катарального гингивита, при этом достичь устойчивой стабилизации патологического процесса в тканях пародонта сложно. Вопрос определения оптимального подхода к лечению данной категории больных является весьма актуальным и требует проведения дальнейших исследований. Лечение заболеваний пародонта важно не только для поддержания здоровья полости рта, но, как показывает анализ литературных источников, и для снижения патологических изменений в тканях пародонта, что даст возможность разработать новый комплексный патогенетически обоснованный подход к лечению генерализованного пародонтита и хронического катарального гингивита, направленный на стойкую стабилизацию дистрофически-воспалительного процесса в тканях пародонта, который одновременно будет способствовать укреплению здоровья пациентов в целом.
В исследовании принимали участия 27 человек, из них 13 мужчина и 14 женщин в возрасте от 25 до 65 лет, с диагнозами: хронический катаральный гингивит средней степени тяжести, хронический генерализованный пародонтит начальной-I и II степени тяжести. Все пациенты были разделены на 2 группы: контрольная – 12 человек и основная – 15 пациентов. Лечение гингивита и пародонтита включало в себя лечение кариеса и его осложнений; обучение пациентов гигиене полости рта и ее контроль; проведение профессиональной гигиены и закрытого кюретажа. Общая противовоспалительная терапия назначалась пациентам с диагнозом генерализованный пародонтит и проводилась с использованием антибактериальных препаратов. Традиционная терапия дополнялась назначением Биогая Продентис, рассасывать 3-4 раза в день в течении 10 дней. В основной группе: при гингивите и начальной-I степени пародонтита после профессиональной гигиены, при пародонтите – после закрытого кюретажа, – применялось введение iPRF в область переходной складки. Всего проводили 3 процедуры с интервалом 10 дней, последующие 2 процедуры вводили – PPP. Оценка результатов: после каждой процедуры – контрольный осмотр; следующий визит – через 6 месяцев. Если необходимо через 6 месяцев проводили поддерживающую терапию – курс профессиональной гигиены с 1 процедурой PPP (если необходимо).

Фото 1. Пациентка М., 28 лет. Диагноз: хронический катаральный гингивит средней степени тяжести. До лечения.

Фото 2. Пациентка М., 28 лет. Диагноз: хронический катаральный гингивит средней степени тяжести. Сразу после лечения: снятие зубных отложений и первой процедуры плазмотерапии – iPRF.
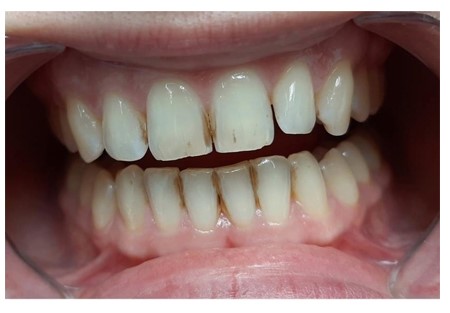
Фото 3. Пациентка М., 28 лет. Диагноз: хронический катаральный гингивит средней степени тяжести. Спустя 3 года после лечения.

Фото 4. Пациент 32 года. Генерализованый пародонтит лёгкой степени тяжести. Зубные отложения. До лечения

Фото 5.Пациент 32 года. Генерализованый пародонтит лёгкой степени тяжести. Зубные отложения. Сразу после скейлинга и инъекций I-PRF.

Фото 6. Пациент 32 года. Генерализованый пародонтит лёгкой степени тяжести. Зубные отложения. Спустя 5 дней после лечения.
Уже через неделю от начала лечения у пациентов основной группы, которым проводили инъекции тромбоцитарной аутоплазмы, отмечалась положительная клиническая динамика, которая выражалась в улучшении показателей гигиенического и пародонтальных индексов на 40 %, в снижении кровоточивости десен на 60 %, уменьшении гиперемии десен. В контрольной группе больных в 70 % случаев в этот срок сохранялись жалобы на кровоточивость десен, ограниченную гиперемию папиллярной десны. Индексные показатели не отличались от исходного уровня.
Через 6 месяцев после проведенного лечения пациентов II (основной) группы признаки воспаления пародонта купировались полностью: отсутствовала кровоточивость, отек, гиперемия десны, уменьшилась глубина зондирования пародонтальных карманов. В контрольной группе больных кровоточивость десен снизилась на 50 % по сравнению с исходными значениями. Отечность папиллярного края десны и глубина пародонтальных карманов оставались на исходном уровне.
Через 12 месяцев у пациентов основной группы клиническое состояние пародонта было стабильным, что подтверждалось отсутствием прироста показателей пародонтальных индексов, восстановлением функции зубов. В контрольной группе индексные значения, характеризующие состояние пародонта, оставались в 2,5 раза более высокими, чем в группе сравнения.
Результаты исследования показали эффективность и, соответственно, обоснованность применения тромбоцитарной аутоплазмы в комплексном лечении заболеваний пародонта. Снижение индексных значений, характеризующих состояние пародонта, во II группе пациентов отмечалось уже к 7 суткам от начала лечения. Аналогичные показатели в контрольной группе в этот срок практически не отличались от исходных. Через 12 месяцев после лечения снижение (нормализация) пародонтальных индексов во II группе произошло на 82 %, а в I (контрольной) – всего на 65 %.
Заключение. Включение тромбоцитарной аутоплазмы в комплексное лечение пародонтита позволяет купировать воспаление и стабилизировать процесс в более короткие сроки по сравнению с общепринятыми методами лечения.
I. ВВЕДЕНИЕ
1. Настоящий порядок распространяется на учебное мероприятие ________________________ (название согласно лэндинга).
II. ПРЕДОПЛАТА И ГАРАНТИЯ МЕСТА
1. Место на учебном мероприятии гарантируется при внесении предоплаты. Сумма предоплаты составляет __________ грн.
2. Предоплата является гарантией места на учебном мероприятии.
3. Участники, записавшиеся на учебное мероприятие и не внесли предоплату, не могут участвовать в мероприятии.
III. ОТКАЗ ОТ УЧАСТИЯ В ЗАПАДЕ
1. Отказ от участия в учебном мероприятии направляется не позднее чем за семь суток, исключительно в электронной форме на адрес Исполнителя.
2. Не принимается отказ по телефону, лично, переданы администратору или через другого участника. Отказ считается принятой, если письмо получено ответ.
3. если участник не направил отказ или не получил подтверждения на отказ, он не может претендовать на возврат суммы предоплаты.
4. Участник принимает на себя все риски недоставки письма и самостоятельно регулирует свои обстоятельства, связанные с доступом к электронной почте. Не срабатывают никакие причины НЕ сообщение об отказе, в том числе «уважительные» (болезнь, отсутствие доступа к компьютеру и т.п.).
IV. Невозвратных ДЕПОЗИТ И ВОЗВРАЩЕНИЕ ОПЛАТЫ ЗА УЧАСТИЕ В ЗАПАДЕ
1. За каждый учебное мероприятие устанавливается сумма невозвращенного депозита. Сумма публикуемой на сайте и составляет 25% от полной суммы стоимости учебного мероприятия. Депозит не возвращается при отказе от участия в учебном мероприятии, в том числе: при фактической неявке при отсутствии с «уважительных» причин. Этот депозит компенсирует административные расходы на организацию мероприятия.
2. Сумма оплаты за мероприятие возвращается за вычетом безвозвратного депозита.
3. Возврат производится только тем участникам, которые сообщили о своем отказе согласно правилам, установленным в разделе «Отказ от участия в мероприятии».
4. На сумму возврата не влияют никакие обстоятельства частной жизни участника, в том числе «уважительные».
5. В случае отмены учебного мероприятия по инициативе организатору сумма предоплаты возвращается в полном объеме.
6. Перенос оплаты на другое учебное мероприятие или другому участнику не производится.
ООО «Мультимед» (далее – ИСПОЛНИТЕЛЬ) в лице Директора Евсеева Леонида Владимировича, который действует на основании Устава, настоящей публичной офертой предлагает любому физическому лицу (далее – ЗАКАЗЧИК) заключить Договор-оферту на оказание услуг по проведению мероприятия, далее – Договор.
В соответствии с со статьёй 435 и частью 2 статьи 437 Гражданского кодекса Украины (далее — “ГК”) в случае принятия изложенных ниже условий и оплаты услуг, лицо, производящее акцепт этой оферты, становится ЗАКАЗЧИКОМ ( В соответствии со статьями 641, 642 ГК акцепт оферты равносилен заключению договора на условиях, изложенных в оферте).
В связи с вышеизложенным, внимательно прочитайте текст данной публичной оферты и, если Вы не согласны с каким-либо пунктом оферты, ИСПОЛНИТЕЛЬ в этом случае предлагает Вам заключить персональный договор на отдельно обсуждаемых условиях.
Полным и безоговорочным акцептом настоящей публичной оферты является осуществление ЗАКАЗЧИКОМ оплаты предложенных ИСПОЛНИТЕЛЕМ услуг. Оплатой услуг считается поступление денежных средств на расчетный счет
1. ИСПОЛНИТЕЛЯ. ОБЩИЕ ПОЛОЖЕНИЯ
1.1.Предметом Договора является предоставление ИСПОЛНИТЕЛЕМ услуг по проведению мероприятия (далее – Мероприятие) для ЗАКАЗЧИКА. Подробное описание Мероприятия публикуется ИСПОЛНИТЕЛЕМ на сайте multimed.education
1.2.По настоящему Договору ИСПОЛНИТЕЛЬ оказывает следующие услуги:
— подготовка программы Мероприятия;
— разработка плана проведения Мероприятия;
— проведение Мероприятия (в том числе с привлечением третьих лиц);
— полное организационное сопровождение Мероприятия.
1.3.Условия, срок (дата), продолжительность и место проведения Мероприятия оговаривается с ЗАКАЗЧИКОМ любым из электронных способов связи (viber, sms, whats app, telegramm, Facebook, mail и др.) ИСПОЛНИТЕЛЯ, которые указаны на сайте multimed.education
1.4.ЗАКАЗЧИК принимает участие в Мероприятии лично (очно) или заочно
1.5.Заключение ЗАКАЗЧИКОМ настоящего Договора осуществляется путем последовательного совершения действий (акцепта публичной оферты), указанных в п. 1.6. Договора.
1.6. Для акцепта Договора ЗАКАЗЧИК совершает последовательно следующие действия:
1.6.1. Осуществляет ознакомление с текстом Договора;
1.6.2. Знакомиться с детальной информацией о Мероприятии на сайте ИСПОЛНИТЕЛЯ;
1.6.3. Осуществляет запрос любым из электронных способов связи (viber, sms, whats app, telegramm, Facebook, mail и др.) ИСПОЛНИТЕЛЯ, которые указаны на сайте multimed.education
1.6.4. Покупает Мероприятие, оплачивая его.
1.7.Настоящий Договор считается заключенным и вступает в силу для Сторон с даты оплаты услуг ЗАКАЗЧИКОМ. Оплата вносится в размере не менее 50% предоплаты. Датой оплаты считается дата поступления денежных средств на расчетный счет ИСПОЛНИТЕЛЯ.
2. УСЛОВИЯ УЧАСТИЯ В МЕРОПРИЯТИИ
2.1.Для заказа Мероприятия ЗАКАЗЧИК должен определится с тематикой и основной концепцией мероприятия на сайте, а также сделать заявку любым из электронных способов связи (viber, sms, whats app, telegramm, Facebook, mail и др.) ИСПОЛНИТЕЛЯ, которые указаны на сайте multimed.education
3. ПРАВА И ОБЯЗАННОСТИ СТОРОН
3.1.ИСПОЛНИТЕЛЬ обязуется:
3.1.1.Осуществлять консультационную поддержку относительно предоставляемых услуг, порядка и правил оформления Заявки по телефону (067)3628066 или посредством электронной почты ( электронный адрес sales@multimed.com.ua )
3.1.2.Организовать и провести Мероприятие в соответствии с условиями его проведения, опубликованными на сайте multimed.education
3.1.3.Предоставить ЗАКАЗЧИКУ возможность принять участие в Мероприятии лично (очно). ЗАКАЗЧИК также может передать право на участие в Мероприятии любому третьему лицу по своему выбору при условии полной оплаты Мероприятия и обязательном письменном уведомлении ИСПОЛНИТЕЛЯ о контактных данных такого лица не позднее, чем за 2 (два) рабочих дня до даты начала Мероприятия, а также при условии одобрения ИСПОЛНИТЕЛЕМ участия такого третьего лица в Мероприятии вместо ЗАКАЗЧИКА.
3.1.4.В случае изменения условий проведения Мероприятия (цены, даты, места проведения и иных изменениях) уведомить ЗАКАЗЧИКА не менее чем за 1 (один) календарный день до начала действия таких изменений.
3.1.5.Вернуть уплаченные денежные средства ЗАКАЗЧИКУ в случае невозможности проведения ИСПОЛНИТЕЛЕМ Мероприятия по причинам, не зависящим от воли ИСПОЛНИТЕЛЯ, за исключением случаев указанных в настоящем договоре.
3.2. ИСПОЛНИТЕЛЬ имеет право:
3.2.1.Проводить фото-, аудио- и видеосъемку во время проведения Мероприятия и использовать полученные материалы по своему усмотрению.
3.2.2.В одностороннем порядке изменять стоимость своих услуг, а также иные условия проведения Мероприятия, а также условия настоящего Договора без предварительного согласования с ЗАКАЗЧИКОМ.
3.2.3. Разрабатывать программу Мероприятия и определять количество и состав выступающих на Мероприятии.
3.2.4. Отказать ЗАКАЗЧИКУ в предоставлении Услуги в случае неоплаты (неполной оплаты) за Услуги в установленные сроки, при нарушении правил участия в Мероприятии. Представители ИСПОЛНИТЕЛЯ также имеют право в любой момент прекратить проведение Мероприятия в случае, если своими действиями такой ЗАКАЗЧИК создает неудобства, а также мешает представителю проводить Мероприятие. В этом случае денежные средства ЗАКАЗЧИКУ не возвращаются.
3.3. ЗАКАЗЧИК обязуется:
3.3.1.Самостоятельно и своевременно уведомлять ИСПОЛНИТЕЛЯ о дате, времени Мероприятия.
3.3.2.Приобретая услуги ИСПОЛНИТЕЛЯ, сделать заявку любым из электронных способов связи (viber, sms, whats app, telegramm, Facebook, mail и др.) ИСПОЛНИТЕЛЯ, которые указаны на сайте multimed.education, а также ознакомиться с утвержденными ИСПОЛНИТЕЛЕМ и опубликованными на сайте multimed.education правилами проведения выбранного Мероприятия.
3.3.3.Оплатить выбранное Мероприятие на условиях и по цене, действующих на данное Мероприятие в момент оплаты.
3.3.4.В случае передачи права на участие в Мероприятии третьему лицу не позднее, чем за 2 (два) рабочих дня до начала Мероприятия, уведомить об этом ИСПОЛНИТЕЛЯ и в письменной форме сообщить все необходимые данные нового участника.
3.3.5.Уведомить ИСПОЛНИТЕЛЯ об изменении своих контактных (персональных) данных в письменной форме в течение суток с момента таких изменений.
3.3.6.В электронной форме уведомить ИСПОЛНИТЕЛЯ об отказе от участия в Мероприятии не позднее, чем за 14 (четырнадцать) календарных дней до начала Мероприятия, что влечет за собой следующее:
-в случае уведомления об отказе от участия в Мероприятии в срок более чем за 14 (четырнадцать) каледарных дней до начала Мероприятия уплаченные ЗАКАЗЧИКОМ денежные средства возвращаются ИСПОЛНИТЕЛЕМ в полном объеме.
-в случае уведомления об отказе от участия в Мероприятии в срок менее чем за 14 (четырнадцать) каледарных дней до начала Мероприятия — уплаченные ЗАКАЗЧИКОМ денежные средства не возвращаются ИСПОЛНИТЕЛЕМ. Однако ИСПОЛНИТЕЛЬ берет на себя обязательство предоставить ЗАКАЗЧИКУ возможность принять участие в последующих мероприятия в рамках суммы, которую он оплатил.
– в случае не уведомления об отказе от участия в Мероприятии денежные средства не возвращаются ИСПОЛНИТЕЛЕМ.
3.3.7. Приходить на Мероприятия точно ко времени, согласованном в электронных средствах связи. В случае опоздания ЗАКАЗЧИКА уплаченные денежные средства при не возвращаются и не пересчитываюся.
3.3.8. ЗАКАЗЧИК обязуется не проводить фото и видео съемку, а также аудиофиксацию посредством технических и электронных средств и приспособлений во время проведения мероприятия.
3.4 .ЗАКАЗЧИК имеет право:
3.4.1. Требовать от ИСПОЛНИТЕЛЯ соблюдение условий настоящего Договора.
3.4.2. Участвовать в МЕРОПРИЯТИЯХ лично (очно) либо передать право на участие иному лицу при условии полной оплаты Мероприятия и своевременного (не позднее, чем за 2 (два) рабочих дня до начала Мероприятия) письменного уведомления об этом ИСПОЛНИТЕЛЯ.
4. ОТВЕТСТВЕННОСТЬ СТОРОН
4.1. В случаях неисполнения или ненадлежащего исполнения своих обязательств по Договору, Стороны несут ответственность в соответствии с законодательством Украины с учетом условий настоящего Договора.
4.2. ИСПОЛНИТЕЛЬ не несет ответственности в случае ненадлежащего оказания услуги, если ненадлежащее исполнение явилось следствием недостоверности, недостаточности или несвоевременности предоставленных ЗАКАЗЧИКОМ сведений, а также вследствие других нарушений условий настоящего Договора со стороны ЗАКАЗЧИКА.
4.3. ИСПОЛНИТЕЛЬ не несет ответственности за несоответствие предоставленной услуги ожиданиям ЗАКАЗЧИКА и/или за его субъективную оценку, такое несоответствие ожиданиям и/ или отрицательная субъективная оценка не являются основаниями для возврата уплаченных денежных средств.
4.4. ИСПОЛНИТЕЛЬ освобождается от ответственности за полное или частичное неисполнение обязательств, предусмотренных настоящим Договором, если это неисполнение явилось следствием обстоятельств непреодолимой силы, возникших после заключения Договора, в результате событий чрезвычайного характера, которые Стороны не могли ни предвидеть, ни предотвратить разумными мерами (форс-мажор).
4.5. В случае, если ЗАКАЗЧИК по причинам, не зависящим от ИСПОЛНИТЕЛЯ, не посетил Мероприятие и не уведомил ИСПОЛНИТЕЛЯ о своем желании отказаться от предоставленных услуг в сроки, указанные в п. 3.3.6. Договора, то услуга считается оказанной надлежащим образом и уплаченные ИСПОЛНИТЕЛЮ денежные средства возврату не подлежат.
5. РАЗРЕШЕНИЕ СПОРОВ
5.1. Все споры и разногласия, возникшие в связи с исполнением Договора, решаются Сторонами путем переговоров. Устанавливается обязательный претензионный порядок разрешения споров, — до обращения в суд Сторона обязана направить другой Стороне письменную претензию, и только после истечения 15 (пятнадцати) календарных дней с даты ее получения другой Стороной может обратиться с иском в суд.
5.2. В случае не достижения согласия между Сторонами, все споры рассматриваются в судебном порядке, в соответствии с законодательством Украины.
6. ИНТЕЛЛЕКТУАЛЬНАЯ СОБСТВЕНОСТЬ
6.1. Все информационные материалы, предоставляемые ИСПОЛНИТЕЛЕМ ЗАКАЗЧИКУ в процессе проведения Мероприятия, а также фото-, аудио- и видеосъемка, проводимая во время Мероприятия, являются интеллектуальной собственностью ИСПОЛНИТЕЛЯ, все права на которую защищены законодательством Украины.
6.2. Незаконное использование (воспроизведение, распространение, импортирование, публичный показ и т.д.) указанных материалов, информации, произведений и учебных пособий ИСПОЛНИТЕЛЯ без письменного согласия последнего влечет за собой гражданскую, административную и иную ответственность в соответствии с действующим законодательством Украины.
7. ПРОЧИЕ УСЛОВИЯ
7.1. Настоящий Договор действует до момента исполнения Сторонами всех обязательств.
7.2. Предоставленная ЗАКАЗЧИКОМ информация, предоставленная электронным способом связи, является неотъемлемой частью настоящего Договора.
7.3. Заключая настоящий Договор, ЗАКАЗЧИК дает согласие на сбор и обработку ИСПОЛНИТЕЛЕМ персональных данных ЗАКАЗЧИКА согласно закону от 27.07.2006 №152 «О персональных данных» и положению о соответствующем Мероприятии, утвержденному ИСПОЛНИТЕЛЕМ и опубликованному на его сайте в сети Интернет. Обработка персональных данных включает, в том числе, совершение следующих действий: обработку (включая сбор, систематизацию, накопление, хранение, уточнение (обновление, изменение)), использование и все прочие действия, связанные с целями и задачами конкретного Мероприятия.
7.4. ЗАКАЗЧИК также дает согласие на использование персональной информации о себе, своих взаимоотношениях с ИСПОЛНИТЕЛЕМ, на использование ИСПОЛНИТЕЛЕМ всей предоставленной ЗАКАЗЧИКОМ информации о себе, своем бизнесе, публикацию материалов о факте получения услуг у ИСПОЛНИТЕЛЯ в средствах массовой информации – на телевидении, радио, в интернете, в печатных изданиях, социальных сетях, а также публикацию указанных материалов на официальном сайте и в социальных ресурсах ИСПОЛНИТЕЛЯ.ИСПОЛНИТЕЛЬ обязуется прекратить хранение и обработку персональных данных ЗАКАЗЧИКА в случае, если ЗАКАЗЧИК уведомил его о такой необходимости. Уведомление может быть предоставлено в письменной форме по электронной почте sales@multimed.com.ua
7.5. Заключая настоящий Договор, ЗАКАЗЧИК дает согласие на проведение ИСПОЛНИТЕЛЕМ фото-, аудио- и видеосъемки во время Мероприятия, в том числе самого ЗАКАЗЧИКА, с последующим использованием этих фото-, аудио- и видеоматериалов. В случае несогласия ЗАКАЗЧИКА на предоставление прав на использование его изображения, он уведомляет об этом ИСПОЛНИТЕЛЯ в письменной форме по электронному адресу sales@multimed.com.ua не не позднее, чем за 3 рабочих дня до проведения Мероприятия.
7.6.В том случае, если какие-либо условия Мероприятия, размещенные на сайте ИСПОЛНИТЕЛЯ multimed.education или отраженные в иных информационных материалах ИСПОЛНИТЕЛЯ о проводимом Мероприятии, будут противоречить условиям настоящего Договора, то Стороны будут руководствоваться условиями настоящего Договора.
7.7.Во всем остальном, что не предусмотрено настоящим Договором, отношения сторон регулируются действующим законодательством Украины.
7.8.ЗАКАЗЧИК подтверждает, что все условия настоящего Договора ему ясны, и он принимает их безусловно и в полном объеме.
Мария Лянкэ, Маркетолог
+38 095 791 18 62
Соблюдение конфиденциальности пользовательских данных — один из основополагающих принципов работы компании ООО “Мультимед”. Положение о конфиденциальности и методы работы направлены на обработку персональных данных надлежащим и законным образом и на обеспечение их конфиденциальности, сохранности и доступности.
Данное Положение о конфиденциальности распространяется на сайт center.multimed.education, находящийся в пользовании и управлении ООО “Мультимед”, зарегистрированной в г. Одесса, Украина.
Данное Положение о конфиденциальности представляет собой полное изложение политики конфиденциальности персональных данных в интернете, применимой к деятельности нашей компании. Положение объясняет, какие виды данных мы собираем, а также как мы используем, передаём и защищаем предоставляемую вами информацию. Оно также описывает ваши возможные действия касательно использования и исправления ваших персональных данных, а также доступа к ним.
Деятельность нашей компании регулируется Общим регламентом по защите данных (ЕС) 2016/679 (GDPR), который является законодательным актом, обладающим прямой обязательной силой. GDPR защищает основополагающие права и свободы физических лиц, в частности их право на защиту персональных данных.
ОПРЕДЕЛЕНИЯ
Персональные данные
Персональные данные — это любая информация, которая относится к идентифицированному или поддающемуся идентификации физическому лицу. К персональным данным относятся все виды информации, которые прямо или косвенно идентифицируют человека: имя, email, телефонный номер и т.д.
Принципы
– В основе Положения о конфиденциальности лежат следующие принципы защиты данных:
– Персональные данные должны обрабатываться законным, добросовестным и прозрачным образом;
– персональные данные должны собираться исключительно для достижения строго определённых, однозначных и законных целей и не должны дополнительно обрабатываться не совместимым с этими целями образом;
– сбор персональных данных должен осуществляться корректным образом и ограничиваться исключительно релевантными сведениями, необходимыми для достижения цели, которую преследует обработка этих данных;
– персональные данные должны быть точными и при необходимости должны обновляться;
– должны приниматься все разумные меры, гарантирующие незамедлительное удаление или исправление персональных данных, обнаруживающих неточность, важную для цели их обработки;
– персональные данные должны храниться таким образом, который позволяет идентифицировать человека исключительно на период времени, необходимый для достижения цели, которая преследуется путём обработки этих данных;
– все персональные данные не подлежат разглашению и должны храниться таким образом, который обеспечивает их надлежащую защищённость;
– персональные данные не подлежат передаче третьим лицам, за исключением случаев, когда такая передача необходима для того, чтобы AirHelp смог предоставить услуги, предусмотренные Соглашением;
– у вас есть право на доступ к персональным данным, на изменение или удаление данных, на ограничение или возражение против обработки данных, а также право на перенос данных.
Сбор и использование персональных данных
Если вы хотите воспользоваться нашими услугами и передаёте информацию, мы можем попросить вас предоставить персональные данные для того, чтобы мы могли осуществлять свою работу, оказывать свои услуги и повышать их уровень.
Персональные данные могут передаваться посредством нашего сайта, электронной почты или других поддерживаемых нами электронных или программных решений, а также почтовым отправлением или по телефону. Сбор всех персональных данных ведётся в соответствии с GDPR. Мы обрабатываем персональные данные исключительно в объеме, необходимом для достижения строго определённых, однозначных и законных целей, либо для достижения цели, достижение которой требуется законодательством страны, в которой мы работаем.
Персональные данные, которые мы собираем в первую очередь, включают в себя имена, адреса электронной почты, телефонные номера. Мы собираем эти персональные данные в целях предоставления наших услуг, предусмотренных Публичной офертой.
Помимо этого, мы собираем персональные данные для иных целей, например для ведения статистики, решения административных и коммуникационных задач, совместной работы над внутренними проектами и активностями и совместной работы подразделений организации.
Использование персональных данных
Мы используем персональные данные в тех целях, для достижения которых они собираются, и храним их лишь в течение времени, необходимого для достижения данных целей. Мы можем хранить информацию о вас, пока это является необходимым для предоставления наших услуг, для выполнения наших юридических обязательств или для достижения любой из перечисленных выше целей. Доступ к персональным данным предоставляется исключительно сотрудникам ООО “Мультимед”, а также контролируемых аффилированных организаций, имеющим соответствующее разрешение и чёткую рабочую необходимость в доступе к данным.
Использование cookie-файлов
Наш сайт и наши партнёры используют cookie-файлы или похожие технологические решения для обеспечения максимального удобства пользователя и для анализа тенденций, управления сайтом, отслеживания поведения пользователя на сайте и для сбора демографической информации о нашей клиентской базе в целом.
Cookie-файлы — это небольшие текстовые файлы, записываемые в памяти вашего устройства для отслеживания паттернов пользовательского поведения и учёта предпочитаемых параметров. Наши cookie-файлы не содержат информацию, которая может напрямую идентифицировать человека. Мы автоматически собираем определённую информацию с помощью cookie-файлов и трекинговых инструментов, например адрес интернет-протокола (IP-адрес); тип браузера; интернет-провайдер (ISP); страницы, с которых пользователь зашёл на сайт и с которых покинул сайт; просмотренные на нашем сайте файлы (например HTML-страницы, изображения); операционная система; метка даты и времени; и/или статистика кликов для анализа общих тенденций и для управления сайтом. Вы можете контролировать использование cookie-файлов на уровне своего браузера, но если вы решите отключить cookie-файлы, это может привести к ограничению доступности определённых функций и возможностей нашего сайта.
Передача персональных данных
Мы передаём персональные данные третьим сторонам только при следующих обстоятельствах:
– если вы дали на это согласие;
– если цель этой передачи данных напрямую связана с целью, для достижения которой персональные данные собирались изначально;
– если это необходимо для подготовки, уточнения и исполнения Соглашения с вами;
– если это требуется законом, административным или судебным распоряжением;
– если это требуется для обоснования или защиты исковых заявлений или для защиты судебного иска;
– если это необходимо для выполнения правомерного требования органов государственной власти, в том числе служб национальной безопасности и правоохранительных органов;
– если это требуется для предупреждения злоупотребления или иных неправомерных действий, например скоординированных атак, с целью обеспечения сохранности данных.
Безопасность обработки данных
Безопасность ваших персональных данных важна для нас. Мы обрабатываем персональные данные, заботясь об их защищёности, внедряем и поддерживаем надлежащие и общепризнанные стандарты технических и организационных мер по защите персональных данных от случайного или противоправного уничтожения или случайной утери, изменения, недозволенного разглашения или доступа, в частности, если обработка подразумевает передачу данных по сети, а также по защите от других форм противоправного использования.
Ваши права на защиту персональных данных
У вас есть право в любое время запрашивать доступ к персональным данным, их исправление или удаление, запрещать их обработку или возражать против их обработки, а также право на перенос данных. С целью поддержания актуального состояния персональных данных рекомендуем вам сообщать нам о любых изменениях или неточностях.
Маркетинговые email-рассылки и рекламные предпочтения
С вашего согласия мы можем отправлять вам маркетинговые письма. Согласие, о котором здесь идёт речь, должно предоставляться добровольно, осознанно и однозначно. Вы всегда можете возразить против использования ваших персональных данных в целях прямого маркетинга без необходимости предоставлять причину такого возражения, по предварительному запросу и бесплатно. Вы можете сделать это, нажав на ссылку «Отписаться» в любом из полученных от нас писем.
Маркетинговые письма содержат информацию, которая, по нашему мнению, может быть вам интересна, например новости о наших продуктах и услугах.
Жалобы
Вы имеете право направлять жалобы касательно того, как мы обрабатываем ваши персональные данные. Все запросы и жалобы должны своевременно и в соответствии с внутренними правилами рассматриваться специалистом по защите персональных данных (DPO).
Жалобы можно направлять по адресу marketing@multimed.com.ua.
Внесение изменений в данное Положение о конфиденциальности
Периодически в данное Положение о конфиденциальности могут вноситься изменения, например в случае изменений соответствующего законодательства или корпоративной структуры нашей компании.
Мария Лянкэ, Маркетолог
+38 095 791 18 62
В соответствии с действующим законодательством Украины, Администрация отказывается от каких-либо заверений и гарантий, предоставление которых может иным образом подразумеваться, и отказывается от ответственности в отношении Сайта, Содержимого и их использования.
Ни при каких обстоятельствах Администрация Сайта не будет нести ответственности ни перед какой стороной за какой-либо прямой и/или косвенный ущерб в результате любого использования информации на этом Сайте или на любом другом сайте, на котором имеется гиперссылка с нашего cайта; возникновение зависимости; снижения продуктивности; увольнения или прерывания трудовой активности, а равно и отчисления из учебных учреждений; за любую упущенную выгоду; приостановку хозяйственной деятельности; потерю программ или данных в Ваших информационных системах или иным образом, возникшие в связи с доступом, использованием или невозможностью использования Сайта, Содержимого или какого-либо связанного интернет-сайта, или неработоспособностью, ошибкой, упущением, перебоем, дефектом, простоем в работе или задержкой в передаче, компьютерным вирусом или системным сбоем, даже если администрация будет явно поставлена в известность о возможности такого ущерба.
Мария Лянкэ, Маркетолог
+38 095 791 18 62